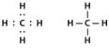Ideias, quem é que pode definir com exatidão o que é ideias? é simples...Pensamentos?Ou é algo tão complexo que Platão preferiu partir do mundo inteligível?Ou uma questão que faz mudar o sentindo do realismo? Este blog tem como objetivo reunir tais ideias, e promover discussões a base delas. Bem vindos!
terça-feira, 21 de maio de 2013
Grupos Funcionais Comuns
Galera querida, a primeira aula de orgânica que expôs esse assunto para nós, o quadro ficou meio bagunçado, esse resumo é como o quadro organizado por Jonh McMurry. No livro de McMurry tem uma tabela logo no inicio do volume 1 depois de ressonância, que explica os grupos funcionais. Eis ela aqui. Neste mesmo capítulo, explica minuciosamente os grupos cabono- carbono, ou carbono-elemento mais eletronegativo, enfim. Foi com base nele que apresento essa tabela, até para conhecermos melhor os grupos funcionais para depois vermos propriedades e etc. Sempre quando eu fizer resumos particulares sobre diversos assuntos (mentira, a maioria é química) postarei aqui. :) Boa Leitura
domingo, 12 de maio de 2013
Revisão de Química
ISSO NÃO É APOSTILA
DIDÁTICA, É APENAS UMA AJUDA, CONSULTE SEU PROFESSOR E TIRE TODAS AS SUAS
DÚVIDAS.
Resumo de Elizabete
Alguns materiais são sólidos,
enquanto outros são elásticos como borracha ou conduzem eletricidade e outros
não, enquanto alguns se quebram facilmente e assim por diante. Mas por que isso
acontece? Isso se deve em grande parte, as ligações
químicas entre os átomos e á arrumação entre eles. Sabemos que os átomos em
sua maioria não ficam isolados, pois assim ficam instáveis. Assim eles tendem a
compartilhar ou doar os seus elétrons segundo a regra do octeto.
O orbital p tem formato de halteres, e é tridimensional, com capacidade de 6 elétrons.
|


Esses elétrons responsáveis pelas
ligações químicas são os presentes na camada de valência, os elétrons presente
na camada mais externa. A ligação química só pode ocorrer se houver redução de
energia em comparação com os átomos separados. Existem 3 tipos de ligações
diferentes, uma é quando os átomos trocam elétrons entre si, a outra eles usam
elétrons em parceria.
A ligação iônica é o resultado da atração eletrostática de íons de cargas
opostas, traduzindo isso quando a diferença de eletronegatividade entre
dois átomos é tão grande, que o elétron rodea mais o outro átomo, sendo que um
perde e outro recebe elétron.
Exemplo:
[ Mg]2+ [ Cl ]-2
Ela ocorre geralmente entre
metais e ametais.
A ligação covalente é quando os
eletrons são compartilhados entre o atómos, em geral são feitas por ametais e
hidrogênio, e ametais com ametais. A diferença de eletronegatividade entre os
átomos é pequena , assim essa ligação forma pares de eletrons.
Existe a ligação covalente
coordenada, que são os pares cedidos para outro átomo, como no caso do anidrido
sulfúrico (SO3). Para representar essa ligação existe a estrutura
molecular com apenas os elétrons da camada de valência.
Lembra-se?
|
|
4 ligações simples
|
4 sigmas
|
1 dupla e 2 simples
|
1 pi e 3
sigmas
|
1 simples e 1 tripla
2 duplas
|
2 pi e 2 sigmas
|
Mas como essas moléculas estão no
espaço? A teoria de Lewis não consegue explicar apenas. Assim podemos explicar
por meio da geometria espacial e da hibridação. É a teoria da hibridação que
fornece explicações para a geometria observada nas moléculas. Vamos ver o
exemplo do CH4
I I
|
I | I |
Essa é a configuração eletrônica
do Carbono no estado fundamental, aqui, percebe-se que apenas poderia existir
CH2, não existe espaço para mais 2 hidrogênios.
| I | I | I |
I
|
O eletron que estava no orbital
s, foi excitado para o orbital p. Até aí tudo bem, mas algo mais mudou, os
hidrogênios não podem se ligar nos
orbitais 2s, 2px, 2py, 2pz, pois a sua
arrumação é de 90º. Assim concluíram que ocorreu uma hibridação dos orbitais s e p, que deu origem a novos 4 orbitais sp3.
A arrumação dele é tetraédrica, ou seja o carbono fica no centro e os 4
hidrogênios se arrumam como uma pirâmide. Preste atenção, como no metano,
quando o carbono se liga com 4 atómos
por meio de ligação sigma a sua geometria é tetraédrica. Não precisa gravar, é só se lembrar do
metano (CH4).
O nitrogênio e o oxigênio também
se hibridizam, porém sem ativação. A molécula da água por exemplo, é em um
orbital híbrido sp3.
Hibridação do Oxigênio
|
||
Estado fundamental
|
Estado Hibridado
|
|
Orbitais
|
2s2 2px1 2py1
2pz1
|
4 orbitais sp3
|
ligações
|
2
|
2
|
geometria
|
Tetraédrica
|
|
Mas por que a água é angular? A repulsão
dos pares não-ligantes é mais forte do que a ligação com os hidrogênios, aí o
que era um tetraedro com 109, 7º diminui e fica 104, 5º vira um ângulo, por isso a
ligação é angular.
Molécula da água
Em barbosa, explica o por que da
hibridização do oxigênio, interfere na arrumação molecular. A do nitrogênio também,
como no caso da amônia. Perceba que originalmente toda hibridização sp3 é tetraédrica, mas leve em conta a repulsão
dos pares não-ligantes.é importante notar que as ligações N-H fazem entre si
ângulos de 107.8º, isto é, na amónia os ângulos de ligação são ligeiramente
inferiores aos ângulos de uma geometria tetraédrica perfeita (109.5º). Por isso
a geometria na amônia é piramidal (BARBOSA, 2004).
Geometria tetraédrica perfeita orbitais p sem hibridização
Hibridação sp2
A ligação do eteno (CH2
= CH2) encontramos uma ligação diferente, a ligação π, assim a
arrumação será diferente e a hibridação também.
Aqui, nem todos os orbitais se
hibridizam, pois os orbitais híbridos só fazem ligação sigma.
I
|
I
|
I |
I |
Três orbitais: sp 2
Um orbital p puro
No momento da ligação, podemos
reconhecer da seguinte forma: Se você ver o carbono fazendo ligação dupla, é sp2. Por quê? Por que na ligação dupla, é uma
sigma e outra pi, e SÓ ORBITAL P PURO
FAZ LIGAÇÃO PI.
Existem outras hibridações sp2
?
Orbitais sp
Neste caso, o carbono se liga por
meio de duas ligações sigma e duas pi, apresentando hibridação sp. Neste caso,
existe apenas dois orbitais híbridos. A estrutura não se restringe a duas
ligações duplas como no caso do aleno, podemos ver orbitais sp no HCN, onde os
átomos de carbono e nitrogênio apresentam hibridação sp.
Referencias Bibliográficas:
BARBOSA, L.C.A Introdução a
química orgânica- São Paulo, Prentice hall, 2004.
FELTRE.R. Química geral. Editora
moderna, vol. 1, 2004.
Apostilas esplanadas :
http://www.colegiodinamico.com.br/PAGINAS/ALUNO/o_professor/arquivos/arilson/arilson_2011_3o_ano_%20aula3_hibridizacao_opt.pdf
Assinar:
Comentários (Atom)